accueil du site.
Version pdf : 03pH-acides-bases-latins.pdf
Version opendocument : 03pH-acides-bases-latins.odt
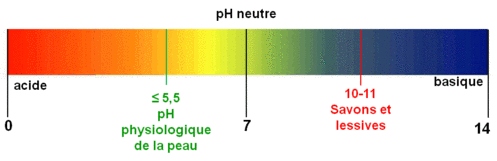
Le pH est une échelle de repérage sans unité, qui permet de donner le caractère acide, neutre ou basique (alcalin) des solutions aqueuses.

Le pH dépend de la concentration des acides ou des bases. Si on dilue 10 fois un acide, le pH augmente environ de 1.
Exemple : L'acide chlorhydrique est un acide fort. Si une solution de cet acide a un pH =1 et qu'elle est diluée 100 fois (100 = 102), on obtient une solution de pH = 1+2=3
Si on dilue dix fois une base, le pH diminue de 1.
Exemple : Une solution de soude de pH 12 est diluée 100 fois, on obtient un pH de 10.
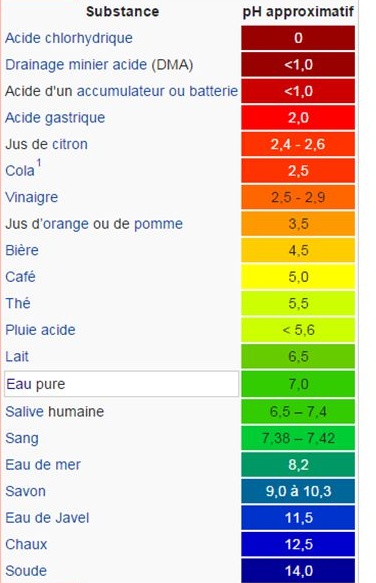
Le pH peut se mesurer avec des indicateurs colorés, comme le jus de chou rouge.
Le papier pH est imprégné de divers indicateurs colorés .
On peut utiliser aussi, avec précautions, un pHmètre. Cet appareil doit être calibré à l'aide de solutions tampon.
L'acide chlorhydrique
HCl dilué dans l'eau donne (H+ + Cl-) / (un ion hydrogène et un ion chlorure).
L'acide sulfurique
H2SO4 dans l'eau donne (2H+ + SO42-) / (2 ions hydrogène et un ion sulfate).
Autres exemples : vinaigre (acide éthanoïque ou acide acétique C2H6O2 ), jus de citron (acide citrique) , acide phosphorique, acide carbonique...
Un acide est une espèce chimique susceptible de libérer des ions hydrogènes H+ en solution aqueuse
.
Les acides attaquent particulièrement les métaux.
La soude caustique
NaOH à l'état solide, et en solution aqueuse (Na+ + OH-)
La potasse
(K+ + OH-)
L'ammoniaque, L'eau de chaux, ...
Une base est une espèce chimique susceptible de fournir des ions hydroxydes OH- en solution aqueuse.
Les bases attaques particulièrement la matière organique. On se sert de la soude pour détruire les matières organiques qui bouchent les canalisations des éviers, douches, W.C. , etc...
Acides et bases se neutralisent. Si on arrive à l'équilibre avec un bon dosage, ou peut parfois obtenir un sel neutre ou proche de la neutralité.
Exemples :
Acide chlorhydrique + soude donne du chlorure de sodium
Acide sulfurique + chaux, donne du sulfate de calcium, formule de base du gypse (roche) ou du plâtre, fabriqué à partir du gypse.
Les acides attaquent le calcaire, le marbre, les mortiers à la chaux comme le béton romain.
Le calcaire est un carbonate de calcium CaCO3
Le marbre est un calcaire pur chauffé et compressé dans les couches géologiques souterraines.
Si le calcaire ou le marbre est attaqué par un acide ont a un dégagement de dioxyde de carbone.
(H+ + Cl-) + CaCO3 ---> CO2 + (Ca2+ + 2Cl-) + H2O
(réaction non équilibrée. Faites le)
Le dioxyde de carbone CO2 dissous dans l'eau donne de l'acide carbonique. Les oxydes de soufre et d'azote dus à la pollution automobile ou industrielle, ou naturelle (volcans), combinés à l'humidité de l'air ou à la pluie font des acides qui attaquent les monuments anciens.
La chaux est obtenue par cuisson de calcaire. Le calcaire perd le dioxyde de carbone et il reste une poudre blanche, le monoxyde de calcium, qui est la chaux vive.
CaCO3 + chaleur ---> CO2 + CaO
Combiné avec l'eau il donne une base, l’hydroxyde de Calcium (Ca2+ + 2 OH-) ou chaux éteinte.
Mélangée avec du sable on a un mortier, qui prend avec le CO2 de l'air pour reformer un calcaire .
Avec de la pouzzolane, roche volcanique siliceuse, et/ou de la brique pillée, les romains on réussi à réaliser un béton très résistant au temps. C'est ce béton qui a servi pour la voute du Panthéon de Rome, ou pour la coupole de St Sophie de Constantinople.